Halibel is a hot role in bleach,and many people like to cosplay Halibel.Here are some halihel cosplay photos.If you like much more ,you can goto www.cosplayfu.com.There will be more cosplay photos that you like.



Halibel is a hot role in bleach,and many people like to cosplay Halibel.Here are some halihel cosplay photos.If you like much more ,you can goto www.cosplayfu.com.There will be more cosplay photos that you like.



I had shared some gundam cosplay photos ----- Gundam Seed. They are all beautiful and professional.You can see more high quality cosplay photos in www.cosplayfu.com




 「0-1.固体って何からできているの?」に書いたとおり、およそ物質というのは原子の集合体ですが、ここではもう少しつっこんだ話をしてみましょう。
「0-1.固体って何からできているの?」に書いたとおり、およそ物質というのは原子の集合体ですが、ここではもう少しつっこんだ話をしてみましょう。
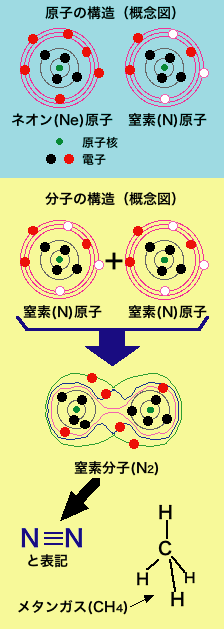
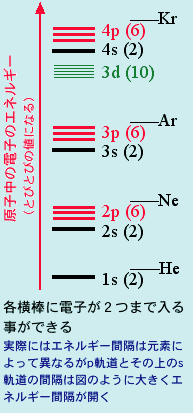 まず、原子そのまま、原子1個が孤立した状態で安定に存在する元素はあるのか?ですが、皆さんどう思いますか?110種類以上の原子(元素)が現在知られていますが、その殆どは同種(例えば酸素O2)あるいは異種の他の原子とくっついて存在しています。でも実はほんの数種類だけ原子1個で安定に存在する元素があります。これらは常温(室温)では全て無色の気体ですから目には見えませんが、希ガスと呼ばれるヘリウム、ネオン、アルゴン、クリプトン等がそうです。左図にはネオンの原子を模式的に書いてありますが、このような希ガスは電子の数が「ちょうど良い」 ため、そこに余計に電子を加えたりそこから電子を1個抜いたイオン状態になってもエネルギーが得をしません。だから中性でしかも1原子で気体として存在す るのです。ここで電子のエネルギーがなぜとびとびなのか、また希ガス原子の電子数だけ詰まった状態から上がえらく離れているのか、というのをしっかり理解 するには量子力学を学んでシュレーディンガー方程式を解いてみないといけないのですが、ここではまあそんなもんか、原子の電子数が2、10、18、36だ と安定なんだなと思って下さい(これらの数字を2で割ると1、1+1+3=5、1+1+3+1+3=9、1+1+3+1+3+5+1+3=18となりま す。このたし算の意味もシュレーディンガー方程式をとくとわかります)。
まず、原子そのまま、原子1個が孤立した状態で安定に存在する元素はあるのか?ですが、皆さんどう思いますか?110種類以上の原子(元素)が現在知られていますが、その殆どは同種(例えば酸素O2)あるいは異種の他の原子とくっついて存在しています。でも実はほんの数種類だけ原子1個で安定に存在する元素があります。これらは常温(室温)では全て無色の気体ですから目には見えませんが、希ガスと呼ばれるヘリウム、ネオン、アルゴン、クリプトン等がそうです。左図にはネオンの原子を模式的に書いてありますが、このような希ガスは電子の数が「ちょうど良い」 ため、そこに余計に電子を加えたりそこから電子を1個抜いたイオン状態になってもエネルギーが得をしません。だから中性でしかも1原子で気体として存在す るのです。ここで電子のエネルギーがなぜとびとびなのか、また希ガス原子の電子数だけ詰まった状態から上がえらく離れているのか、というのをしっかり理解 するには量子力学を学んでシュレーディンガー方程式を解いてみないといけないのですが、ここではまあそんなもんか、原子の電子数が2、10、18、36だ と安定なんだなと思って下さい(これらの数字を2で割ると1、1+1+3=5、1+1+3+1+3=9、1+1+3+1+3+5+1+3=18となりま す。このたし算の意味もシュレーディンガー方程式をとくとわかります)。
さて、単体で安定な原子があるからなんなんだという事ですが、他の多くの原子・元素は少しでも上の希ガスのような状態になろうとして他の原子・元素とくっつくと いうのが物質の成り立ち・起源を考える上で基本的かつ重要なことなのです。これは化学で出てくる結合ってやつですね。で、くっつく方法ですが元の中性原子 の電子数が希ガスのそれに近い場合はてっとり早くよその原子から電子を奪い取るか、逆によその原子に電子を放出することになります。この場合当然相性の良 い相手と手を組むのが理想的になるわけで、その顕著な例が食塩(塩化ナトリウムNaCl)になります。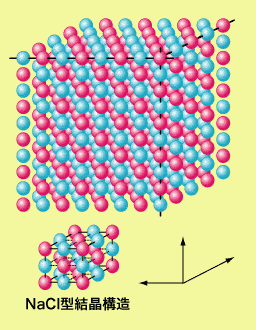 ナトリウムNaは電子を1個放出すると、塩素Clは電子を1個もらうと、それぞれ電子数がネオン、アルゴン原子と同じになり、電子のエネルギーとしては安定な状態になります。しかしそうなると両方ともイオンとなり帯電します。帯電した状態では必ず正なら負、負なら正に帯電した物を引きつけますので、この両者の間で電子のやり取りをした場合は必ず一緒にいるということになり、固体の場合は交互に規則正しく並んだ配置をとった結晶になります。このような結合をイオン結合と呼びます。また、このような固体は水に溶けやすいという性質がありますが、この場合でも水溶液中に同数のイオンがそれぞれとけている訳です。
ナトリウムNaは電子を1個放出すると、塩素Clは電子を1個もらうと、それぞれ電子数がネオン、アルゴン原子と同じになり、電子のエネルギーとしては安定な状態になります。しかしそうなると両方ともイオンとなり帯電します。帯電した状態では必ず正なら負、負なら正に帯電した物を引きつけますので、この両者の間で電子のやり取りをした場合は必ず一緒にいるということになり、固体の場合は交互に規則正しく並んだ配置をとった結晶になります。このような結合をイオン結合と呼びます。また、このような固体は水に溶けやすいという性質がありますが、この場合でも水溶液中に同数のイオンがそれぞれとけている訳です。
では全ての物質は食塩みたいなのか、というとそうなっていなさそうなことは普段の生活から想像できますね。ナト リウムや塩素(前者をアルカリ金属と呼び他にカリウムK、セシウムCsという元素があります。後者はハロゲンと呼ばれ他にフッ素F、臭素Brが似た元素で す)みたいに電子1個だけやりとりすれば済む元素ばかりではありません。例えば窒素原子Nは3個電子が足りないので、なかなかイオン結合で他の原子・イオンとくっつく訳にはいきません。ではどうするのか、というと結果として「ほとんど無害な気体」として存在するのですが、この場合は窒素原子2つ、すなわち同じ元素とペアを組みます。その様子をやはり図に示していますが、窒素原子中の「外側の電子軌道」が接する・交差するまでに互いに原子が近づき、その結果それまで「1個の原子核のまわりをぐるぐる回っていた」電子のいくつかが「2この原子核のまわりをぐるぐるまわる」ようになります。そうなるとそれらの電子は「元々どっちの原子核をまわっていたか」は意味がなくなり、互いに軌道を共有することになります。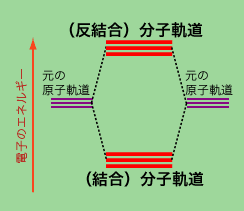 こ のようないくつかの原子軌道を共有したような新たな軌道は、分子1かたまりでみると「分子に属している」ため分子軌道と呼ばれます。そして実は1つの分子 軌道には電子が「2個まで入ることができる」ので、取り合えず結合して電子の総数が偶数個になると希ガス程ではないにしても結構安定な状態になります。さ らに電子を「共有」することで、各々の原子核からみると希ガス分の電子がまわりにいることになって、やはり安定した状態でしかも帯電せず中性です。このよ うな結合を共有結合と呼びますが化学では窒素分子N2を表記する場合「共有する電子が3個あるよ」という事を示す為に上図のような書き方をすることもあります。酸素分子も同様な結合ですが、酸素原子の場合は足りない電子が2個と少し少ない為に他の元素から電子を合計で2個受け取って「酸化物」に なることも非常に多いです。高校の化学では共有結合の例として炭素と水素からなるメタンをよく例にあげられますが、これも共有結合の基本的な構成です。ち なみにこの共有結合というのは生命活動には極めて重要な役割を果たしています。というのもDNA、たんぱく質、脂肪といった体の重要な部分の分子の大部分 は炭素C、窒素N、リンP、酸素O、水素Hの間の共有結合から構成されているのですから。そして体内のいわゆるカロリー消費、食物の消化というのも殆どが 共有結合の変化による反応なのです。
こ のようないくつかの原子軌道を共有したような新たな軌道は、分子1かたまりでみると「分子に属している」ため分子軌道と呼ばれます。そして実は1つの分子 軌道には電子が「2個まで入ることができる」ので、取り合えず結合して電子の総数が偶数個になると希ガス程ではないにしても結構安定な状態になります。さ らに電子を「共有」することで、各々の原子核からみると希ガス分の電子がまわりにいることになって、やはり安定した状態でしかも帯電せず中性です。このよ うな結合を共有結合と呼びますが化学では窒素分子N2を表記する場合「共有する電子が3個あるよ」という事を示す為に上図のような書き方をすることもあります。酸素分子も同様な結合ですが、酸素原子の場合は足りない電子が2個と少し少ない為に他の元素から電子を合計で2個受け取って「酸化物」に なることも非常に多いです。高校の化学では共有結合の例として炭素と水素からなるメタンをよく例にあげられますが、これも共有結合の基本的な構成です。ち なみにこの共有結合というのは生命活動には極めて重要な役割を果たしています。というのもDNA、たんぱく質、脂肪といった体の重要な部分の分子の大部分 は炭素C、窒素N、リンP、酸素O、水素Hの間の共有結合から構成されているのですから。そして体内のいわゆるカロリー消費、食物の消化というのも殆どが 共有結合の変化による反応なのです。
では原子間の結合というのは上の2種類で済むのかというともっと中途半端な電子数の元素も数多くあり、例えば鉄Feなんていうのはその最たる例です。実はこういう元素の多くが「金属」であり、固体では単体金属もしくは合金として存在します。それを金属結合と呼ぶのですがどういう結合なのかは次のページで説明することにしましょう。
(ちょっと大学生向けな話)窒素が酸素よりも安定な理由: 上記の説明は量子力学(化学の分野では量子化学と言います)を少し学んでおくとかなり分かりやすくなります。中性窒素原子の電子配置は(1s)2(2s)2(2p)3で p軌道の数と電子の数が3つで同じです。2原子分子を作るときには2つの原子から3つのp軌道が参加して合計6個の分子軌道を作りますが、この分子軌道の うち3つは元の原子軌道よりもエネルギーの低い結合軌道、残りの3つはエネルギーの高い反結合軌道になります。窒素分子では2p電子が合計6個あり、1つ の分子軌道には(互いに逆向きのスピンを持った)電子が2個入れますので、結果としてこれらの電子は全部結合軌道に入り、結合軌道は全て電子が詰まった状態になり、安定になります。これに対して酸素分子の場合中性酸素原子の電子配置が(1s)2(2s)2(2p)4、分子になると窒素よりも電子が2個多い為反結合軌道にも電子が詰まります。そうすると窒素の時に比べて酸素の時のほうが結合した時のエネルギーの利得が少ないことになり、それゆえに酸素分子は比較的他の物質、元素と反応(これが酸化)しやすくなります。